

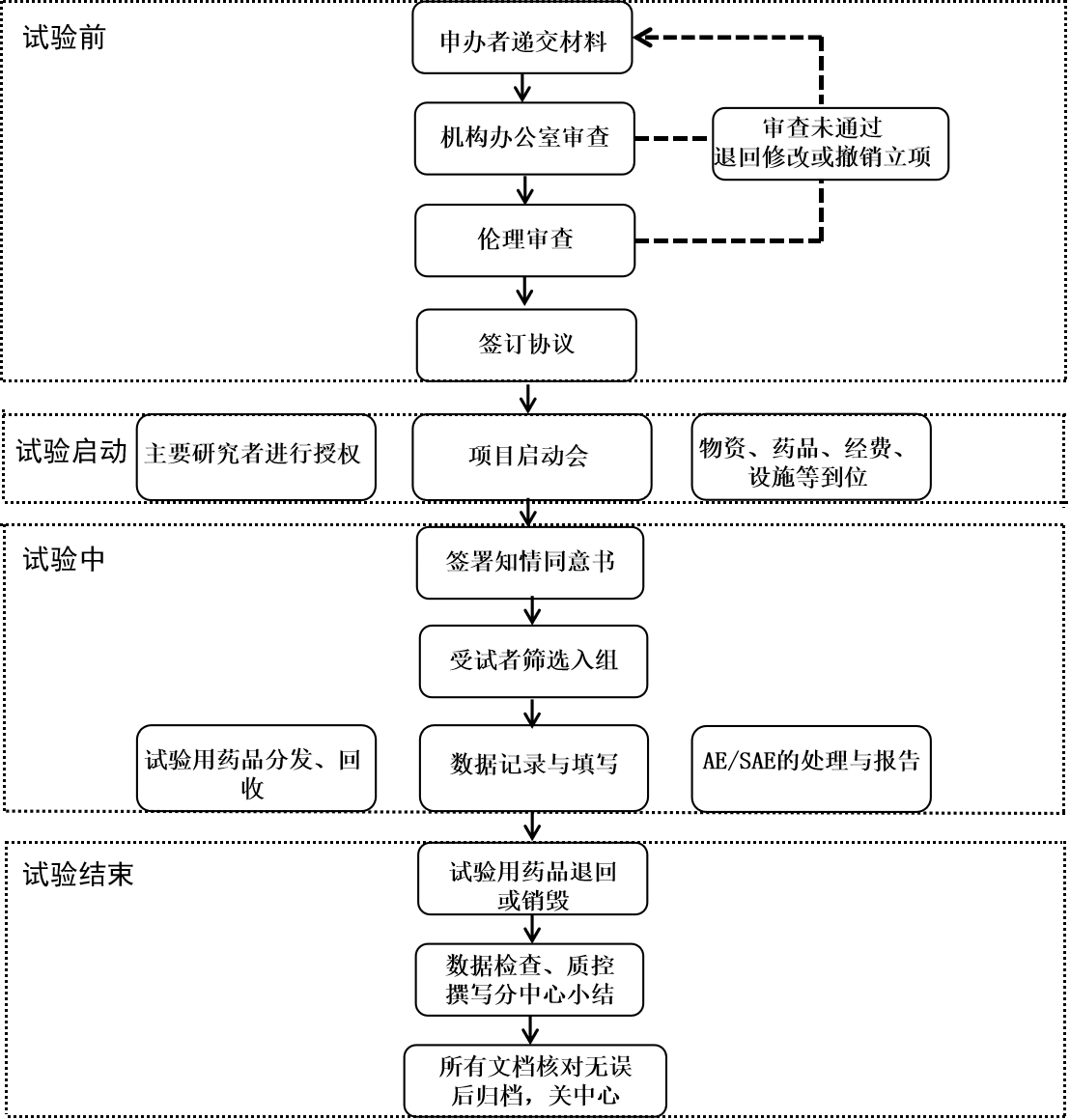
1、新临床试验项目的具体接洽流程:意向沟通,根据药物临床试验项目的具体开展内容,将相关资料发送至机构邮箱:hzsyjgb2023@126.com。机构办根据资料内容与相应专业负责人进行沟通,确定新项目是否承接,并及时回复申办方或CRO。
2、申请:申办方或CRO收到机构办愿意承接项目的意向性回复后,CRA在本院网站下载《药物临床试验项目申请/受理表》,将所需项目材料递交至机构办公室审查,并与PI取得联系,沟通方案及伦理准备事宜等,审机构办审核通过后签署《药物临床试验项目申请/受理表》。
3、伦理审查:立项资料经机构办审查并同意立项后,申办方/CRO向我院伦理委员会递交伦理审查资料;研究方案中牵涉到标本进出口及遗传学方面研究的,请在伦理审查汇报中着重提出,在获得伦理委员会审查同意的伦理批件后,再进行试验合同/协议的审核和签署 (特殊情况下合同审核可与伦理审查同时进行)。
4、在取得伦理批件后进行协议审核,主协议、三方服务协议模板可向机构办秘书获取,推荐使用机构办模板可加快审核速度。协议经商议申办方/CRO、主要研究者、机构办达成一致意见后,先由申办方和CRO(如适用)签字盖章,再递主要研究者审核签字,然后机构办提交院内协议会签流程,最终完成本院协议签署。如系国际合作,需先取得遗传办批件或完成备案,如不涉及。
5、省局备案:在多方协议签署后,须在浙江省食品药品监督管理局药研机构系统进行网上备案。由申办方/CRO提供相关资料,详见《浙江省食品药品监督管理局药研机构系统备案文件清单》,由机构办完成备案。
6、召开启动会:申办方将首批款汇至医院账户,打款后务必在3个工作日内将电子打款凭证发给机构办秘书,方便领取发票。(每次打款务必附言**项目第*次打款,方便财务科出具回执。每次打款均请按以上步骤操作)。经机构办确认相关专业收到研究药物、研究物资、项目预付款且项目已在省局药研机构系统备案后,方能召开启动会,严禁在启动会未召开的情况下筛选和入组受试者。应至少提前一周与机构办沟通启动会时间。
7、药物管理:申办方提前联系临床试验药品管理员,及时开展相应培训后保证在启动会前送达试验药品并按要求贮存。药品运送时,必须随箱附该批次药检报告。
8、质量控制:CRA须在项目启动前到机构备案,递交监查计划,每次监查前需发送监查邮件至机构办邮箱,监查首日到机构秘书处填写《监查登记表》,每次监查后将监查结果发送机构办邮箱并同时存档于研究者文件夹。
9、CRF回收和/或数据锁库:申办方或CRO需在临床试验项目最后一例受试者随访结束后3个月内完成本中心项目结题质控或稽查,并将全部研究资料及结题自查报告提交机构办资料管理员。
10、关中心监查访视:监查员在进行关中心的监查访视前,至少提前一周预约机构质控人员进行关中心前的质控,将财务结算明细汇总表通过邮件发送至机构,预约进行结算。归档文件完整齐全后交机构档案室存档,并留存5年后项目资料转存或销毁等事宜的联系人信息。试验用药品、仪器设备、物资耗材等完成按照研究合同要求退回申办方。
11、分中心小结盖章:申请分中心小结盖章前,申请方须与机构办和主要研究者确认临床试验费用,确保项目相关费用等已全部核算清楚,并已全部到账。
12、项目结题、资料归档:完成分中心小结盖章,方可申请结题和资料归档。除非申请方书面告知该临床试验项目中止或终止后不再用于申报注册。归档文件应按我院《药物临床试验保存文件》要求清点整理,并与机构管理资料一并送到机构办归档保存。如资料归档时不完整(如CRF、总结报告),申请方应在获得缺失的资料后及时转交到机构资料管理员,以确保资料完整。
湖州市第三人民医院药物临床试验工作流程
 浙公网安备 33050202000692号 地址:湖州市苕溪东路2088号
浙公网安备 33050202000692号 地址:湖州市苕溪东路2088号